Навигация
Место дисциплины в профессиональной подготовке студентов
4. Место дисциплины в профессиональной подготовке студентов
Курс «кинетики и термодинамики ферментативных реакций» является заключительным курсом в цикле спецдисциплин федерального компонента, посвященных изучению ферментов. Он имеет основополагающее значение, поскольку главным объектом его изучения являются ферменты – катализаторы всего живого, без которых немыслимыми являются все биохимические процессы.
Распределение времени, отведенного на изучение дисциплины по учебному плану
| Форма учебной работы | Форма обучения | |
| Очная | ||
| По семестрам | ||
| 9 |
| |
| Общая трудоёмкость, всего часов | 80 | |
| Аудиторные занятия (АЗ) | 36 | |
| Лекции (Л) | 24 | |
| Практические занятия (ПЗ) | ||
| Семинары (С) | ||
| Лабораторные занятия (ЛЗ) | 12 | |
| Другие виды аудиторных занятий | ||
| Самостоятельная работа (СР) | 44 | |
| Контрольная работа | + | |
| Компьютерное тестирование | ||
| Курсовая работа | ||
| Форма итогового контроля (зачет, экзамен) | экзамен | |
Тематические планы для очной формы обучения
| № п/п | Тема | Кол-во часов | ||
| Лекц. | Лаб. | Сам. | ||
| Общее число часов | 24 | 12 | 44 | |
| 1. | Введение в кинетику и термодинамику ферментативных реакций. Ранние исследования. История вопроса. | 2 | 2 | 4 |
| 2. | Уравнение Михаэлиса-Ментен. Вывод, анализ. | 2 | 1 | 4 |
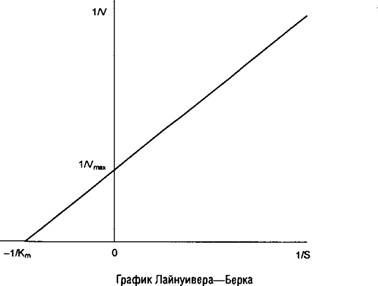
| 3. | Графическое представление ферментативных реакций. | 2 | 1 | 4 |
| 4. | Уравнения стационарной скорости. | 2 | 1 | 4 |
| 5. | Принцип стационарности. Термодинамические представления. | 2 | 1 | 4 |
| 6. | Классификация ингибиторов. | 2 | 1 | 4 |
| 7. | Кинетика и термодинамика ингибиторов. | 2 | 1 | 4 |
| 8. | Механизмы ферментативного катализа. | 2 | 1 | 4 |
| 9. | Уравнения скоростей разных моделей. | 2 | 1 | 4 |
| 10. | Влияние рН и температуры. | 2 | 1 | 4 |
| 11. | Кинетические модели кооперативности. | 4 | 1 | 4 |
Содержание дисциплины
1. Введение
Введение в кинетику и термодинамику ферментативных реакций. Ранние исследования. История вопроса. Законы классической термодинамики в биохимии; теория энергетического сопряжения, богатые энергии соединения.
2. Кинетика и термодинамика ферментативных реакций
Термодинамическое равновесие; методы расчета термодинамических характеристик биохимических реакций; теоретические основы кинетики ферментативных реакций и методы расчета. Уравнение Михаэлиса-Ментен. Вывод, анализ. Принцип стационарности. Методы определения кинетических параметров. Кинетика двухстадийных ферментативных реакций. Графическое представление ферментативных реакций. Термодинамические методы выведения уравнений стационарной скорости. Метод Кинга-Альтмана. рН-зависимости ферментативных реакций. Температурные эффекты ферментативных реакций. Равновесные концентрации реагентов.
3. Кинетика и термодинамика ингибиторов и активаторов
Классификация ингибиторов. Кинетика и термодинамика ингибиторов. Способы определения типов ингибирование по экспериментальным данным. Равновесные концентрации реагентов. Применение ингибиторов.
4. Механизмы ферментативного катализа
Классификация механизмов и схематическое представление. Уравнения скорости. Изотропный обмен. Индуцированный перенос.
5. Контроль ферментативной активности
Необходимость контроля метаболических процессов. Уравнение Хилла. Уравнение Эдера. Уравнение Полинга. Симметричная модель Моно, Уаймена и Шанже. Кинетические модели кооперативности. Последовательная модель Кошланда.
Список основной литературы
1. Березин И.В., Мартинек К. Основы физической химии ферментативного катализа. - М.: Высшая школа, 1977. - С. 216-225.
2. Ленинджер А. Основы биохимии. - М.: Мир, 1985. - 260 с.
3. Курганов Б.И. Аллостерические ферменты. - М.: Наука, 1978. - С. 11-41.
4. Варфоломеев Р.Д., Зайцев С.В. Кинетические методы в биохимических исследованиях. - М.: МГУ, 1982. - 344 с.
5. Введение в мембранологию: Учеб. пос. / Под ред. А.А. Болдырева. - М.: МГУ, 1990. - 208 с.
6. Современные проблемы биокинетики / Под ред. С.Д. Варфоломеева. - М., 1987.
7. Березин И.В., Клесов А.А. Практический курс химической и ферментативной кинетики. - М., 1980.
8. Березин И.В., Варфоломеев С.Д. Биокинетика. - М., 1979.
9. Полторак С.М., Чухрай Е.С. Физико-химические основы ферментативного катализа. - М., 1971.
10. Лапина Г.П. Элементы кинетики ферментативных реакций. -Тверь: ТвГУ, 1998. - 66 с.
Список дополнительной литературы
1. Бейли Дж., Оллис Д. Основы биохимической инженерии / Пер. с англ.: В 2-х ч. - М., 1989.
2. Варфоломеев С.Д., Зайцев С.В. Кинетические методы в биохимических исследованиях. - М., 1982.
3. Введение в прикладную энзимологию / Под ред. И.В. Березина, К. Мартинека. - М., 1982.
4. Дженкс Б. Катализ в химии и энзимологии. - М., 1972.
5. Корниш-Боуден Э. Основы ферментативной кинетики. - М., 1982
Требования к уровню освоения программы
В результате изучения данной дисциплины студент должен:
знать математические модели ферментативных реакций.
уметь определять основные кинетические и термодинамические параметры по экспериментальным данным.
владеть приемами и навыками работы с ферментами.
Перечень вопросов к экзамену
1. Введение в кинетику ферментативных реакций.
2. Ранние исследования.
3. История вопроса.
4. Кинетика одностадийных ферментативных реакций.
5. Кинетика двухстадийных ферментативных реакций.
6. Регуляция ферментативных параметров.
7. Ингибирование (активация) ферментативных реакций.
8. Обратимые и необратимые ингибиторы.
9. Кинетические типы ингибирования (активации).
10. Методы анализа экспериментальных данных.
11. Определение кинетических параметров пероксидазы.
12. Ингибирование субстратом.
13. рН-зависимости ферментативных реакций.
14. Температурные эффекты ферментативных реакций.
15. Интегральная форма уравнения Михаэлиса-Ментен.
16. Термодинамика регуляции ферментативной активности.
17. Кинетико-термодинамические подходы к изучению кооперативного связывания.
18. Классификация механизмов ферментативных реакций.
19. Уравнение стационарной скорости.
20. Справедливость допущений принципа стационарности.
21. Выведение уравнения стационарной скорости.
22. Последовательная модель Кошланда.
Сведения о переутверждении программы на
очередной учебный год и регистрации изменений
| Учебный год | Решение кафедры | Внесенные изменения | Номера листов (страниц) | ||
| заменен-ных | новых | аннули-рованных | |||
| 20__/20__ | Протокол № ____ от «____»____________20_ г. Зав. кафедрой ______________ | ||||
| 20__/20__ | Протокол № ____ от «____»____________20_ г. Зав. кафедрой ______________ | ||||
| 20__/20__ | Протокол № ____ от «____»____________20_ г. Зав. кафедрой ______________ | ||||
Учебная программа составлена на основании ГОС ВПО 2000 г. для специальности 020208–«Биохимия»
Программу составил:
Похожие работы
... ферменты. – М.: Мир, 1983. – 293 с. 4. Бернхард С. Структура и функция ферментов. – М.: Мир, 1971. – 334 с. Требования к уровню освоения программы В результате изучения данной дисциплины студент должен знать классификацию и номенклатуру ферментов, их строение и механизмы функционирования, а также современные методы работы с ферментами. уметь применять приемы номенклатуры ферментов, ...
... составлена в соответствии с Государственным образовательным стандартом Высшего профессионального образования для студентов, обучающихся по специальности 020208 – «Биохимия». 4. Место дисциплины в профессиональной подготовке студентов Курс «Энзимология» предшествует изучению студентов курсов кинетики и термодинамики ферментативных реакций. Он имеет основополагающее значение, поскольку главным ...
... подавления активности ферментов служит одним из способов расшифровки механизма их действия. Подходом к решению последней задачи является изучение специфичности действия ферментов. В свою очередь, это требует корректного измерения кинетических параметров в присутствии изучаемого аналога субстрата. Рассмотрим способы определения характера взаимоотношений субстратов, их аналогов и ингибиторов ...
... , т. е. к увеличению скорости реакции. Количественно зависимость между скоростью реакции и молярными концентрациями реагирующих веществ описывается основным законом химической кинетики — законом действующих масс. Скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ. Для мономолекулярной реакции скорость реакции ...



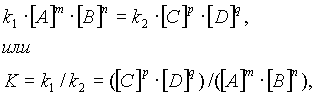
0 комментариев