Навигация
5. Выбор катализатора
Наиболее активным катализатором является платина, однако она вышла из употребления вследствие дороговизны и легкой отравляемости примесями обжигового газа, особенно мышьяком. Окись железа дешевая, но при обычном составе газа - 7% SO2 и 11% О2 она проявляет каталитическую активность только при температурах выше 625 оС, т.е. когда хр 70%, и поэтому применялась лишь для начального окисления SO2 до достижения хр 50-60%. Ванадиевый катализатор менее активен, чем платиновый, но дешевле и отравляется соединениями мышьяка в несколько тысяч раз меньше, чем платина; он оказался наиболее рациональным и только он применяется в производстве серной кислоты. Ванадиевая контактная масса содержит в среднем 7% V2O5; активаторами являются окислы щелочных металлов, обычно применяют активатор К2О; носителем служат пористые алюмосиликаты. В настоящий момент катализатор применятся в виде соединения SiO2, K и/или Cs, V в различных пропорциях. Такое соединение оказалось наиболее устойчивым к кислоте и наиболее стабильным. Во всем мире его более корректное названия "ванадий - содержащий". Такой катализатор разработан специально для работы с невысокими температурами, что приводит в меньшим выбросам в атмосферу. Кроме того - такой катализ дешевле нежели калий/ванадиевый. Обычные ванадиевые контактные массы представляют собой пористые гранулы, таблетки или кольца.
6. Обоснование способа производства
Получение серной кислоты из сероводорода (мокрый катализ) на Пермском нефтеперерабатывающем заводе является малотоннажным производством (65тыс. тонн в год). В основном, это производство создано для того, чтобы снизить выбросы серосодержащих газов и максимально перерабатывать сырье, которое в данном случае является отходом процесса гидроочистки нефти.
Помимо использования сероводорода, в процессе получения серной кислоты протекают 3 реакции:
Н2S + 1,5О2 = SО2 + Н2О
SО2 + 0,5О2 <=> SО3
SО3 + Н2О <=> Н2SО4
Эти три реакции протекают с выделением значительного количества тепла, которое используется для различных нужд цеха производства серной кислоты и в различных целях предприятия: получение пара, который используется в данном производстве, получение пара высокого давления, который используют другие установки, подогрев воздуха, поступающий в котлы для сжигания сероводорода и в контактный аппарат.
Преимущество получения серной кислоты из сероводорода заключается в том, что данный процесс максимально использует и сероводород, и диоксид серы, что в значительной мере снижает выбросы в атмосферу, при проведении процесса, состоящего из 3 реакций, используются невысокие температуры и атмосферное давление, что значительно снижает энергозатраты по сравнению со схемой, которая применяет высокое давление. С учетом того, что в результате технологического процесса выделяется большое количество тепла, процесс, благодаря этому, протекает автотермично.
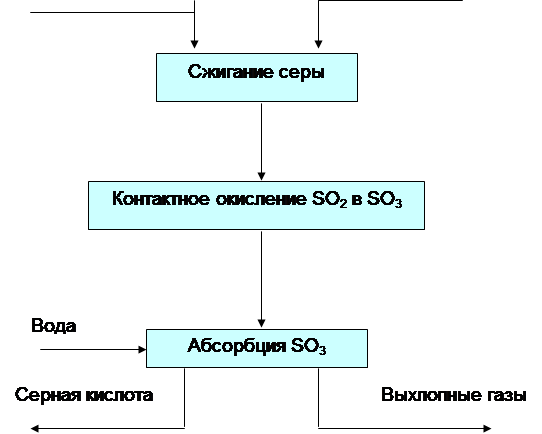
7. Стадии и химизм процесса
Процесс получения серной кислоты методом "мокрого" катализа состоит из следующих основных стадий.
1. Получение сернистого ангидрида (SO2) путем сжигания сероводородсодержащего газа по следующей реакции:
2H2S + 3O2 = 2SO2 + 2 H2O
2. Охлаждение дымовых газов и утилизация тепла реакции горения сероводорода в котле-утилизаторе с получением водяного пара.
3. Окисление сернистого ангидрида до серного ангидрида (SO3) на ванадиевом катализаторе в контактном аппарате (конвертере) R-104 по следующей реакции:
2SO2 + O3 = 2 SO3
4. Получение серной кислоты (H2SO4) путем конденсации в конденсаторе WSA У-109 по реакции:
SO3 + H2O = H2SO4
5. Для получения улучшенной серной кислоты (содержание окислов азота N2O3 менее 0,5 ppm) предусмотрена схема подачи гидразингидрата в поток серной кислоты, поступающей на участок концентрирования серной кислоты.
Гидразинсульфат, полученный при добавлении гидразина к серной кислоте, взаимодействует с нитрозилсернистой кислотой, обуславливающей содержание N2О3 в продуктовой кислоте:
![]() 4NOSO3H + N2H4· H2SO4 3N2 + 5H2SO4
4NOSO3H + N2H4· H2SO4 3N2 + 5H2SO4
Избыток гидразина окисляется с образованием элементарного азота:
![]() N2H4·H2SO4 + O2 N2 +2H2O + H2SO4
N2H4·H2SO4 + O2 N2 +2H2O + H2SO4
Химическийсостав серной кислоты выражается формулой H2SO4. Структурная формула серной кислоты выглядит следующим образом:

Относительная молекулярная масса серной кислоты - 98,08 кг/кмоль.
Безводная серная кислота содержит 100 % H2SO4 или 81,63 % SO3 и 18,37 % мас. H2O. Это бесцветная маслянистая жидкость не имеющая запаха с температурой кристаллизации 10,37 ºС. Температура кипения безводной серной кислоты при давлении 1,01·105 Па (760 мм рт.ст.) составляет 298,2 ºС. Плотность при 20 ºС составляет 1830,5 кг/м3.
С водой и сернистым ангидридом серная кислота смешивается в любых пропорциях.
В процессе производства серной кислоты для окисления сернистого ангидрида в серный применяются ванадиевый катализатор. Он представляет собой пористое вещество, на которое нанесено активное комплексное соединение, содержащее пятиокись ванадия V2O5.
В данном случае применяется катализатор марки VK-WSA фирмы "Хальдор Топсе".
Температура зажигания катализатора 400-430 ºС. При температуре выше 620 ºС активность катализатора быстро снижается, т.к. при этом распадается активный комплекс, содержащий пятиокись ванадия (V2O5), а также разрушается структура носителя, что приводит к разрушению катализатора и образованию пыли.
Срок службы катализатора не менее 4 лет.
Похожие работы
... еще не всегда осуществима. В то же время отходящие газы – наиболее дешевое сырье, низки оптовые цены и на колчедан, наиболее же дорогостоящим сырьем является сера. Следовательно, для того чтобы производство серной кислоты из серы было экономически целесообразно, должна быть разработана схема, в которой стоимость ее переработки будет существенно ниже стоимости переработки колчедана или отходящих ...
... как температура газов снижается добавкой холодного воздуха между слоями. Абсорбция SO3 производится так же, как и в технологической схеме. Важнейшие тенденции развития производства серной кислоты контактным способом: 1) интенсификация процессов проведением их во взвешенном слое, применением кислорода, производством и переработкой концентрированного газа, применением активных катализаторов; ...
... образуется азотная кислота: NO(HSO4) + H2O®H2SO4 + HNO2 Она - то и окисляет SO2 по уравнению: SO2 + 2HNO2®H2SO4 + 2NO В нижней части башен 1 и 2 накапливается 75% - ная серная кислота, естественно, в большем количестве, чем её было затрачено на приготовление нитрозы (ведь добавляется «новорождённая» серная кислота). Окись азота NO возвращается снова на окисление. Поскольку некоторое количество ...
... . Для автоматического регулирования необходимо максимально знать требования, предъявляемые различным химико-технологическим процессом. 1.Основная часть 1.1 Технологический процесс получение серного ангидрида при получении серной кислоты. Производство серной кислоты контактным способом состоит из следующих действий: 1. Разгрузка, складирование и подготовка сырья ...







0 комментариев